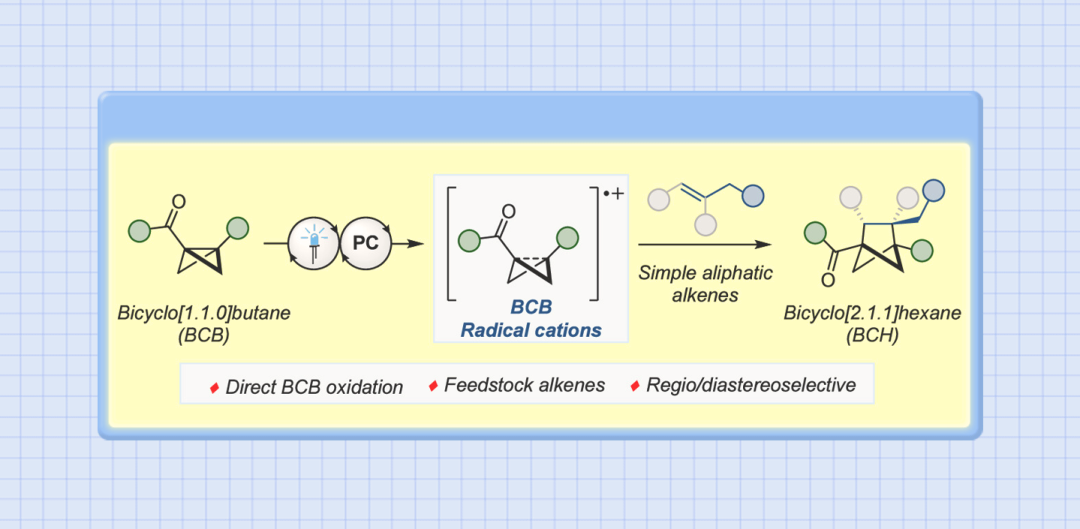
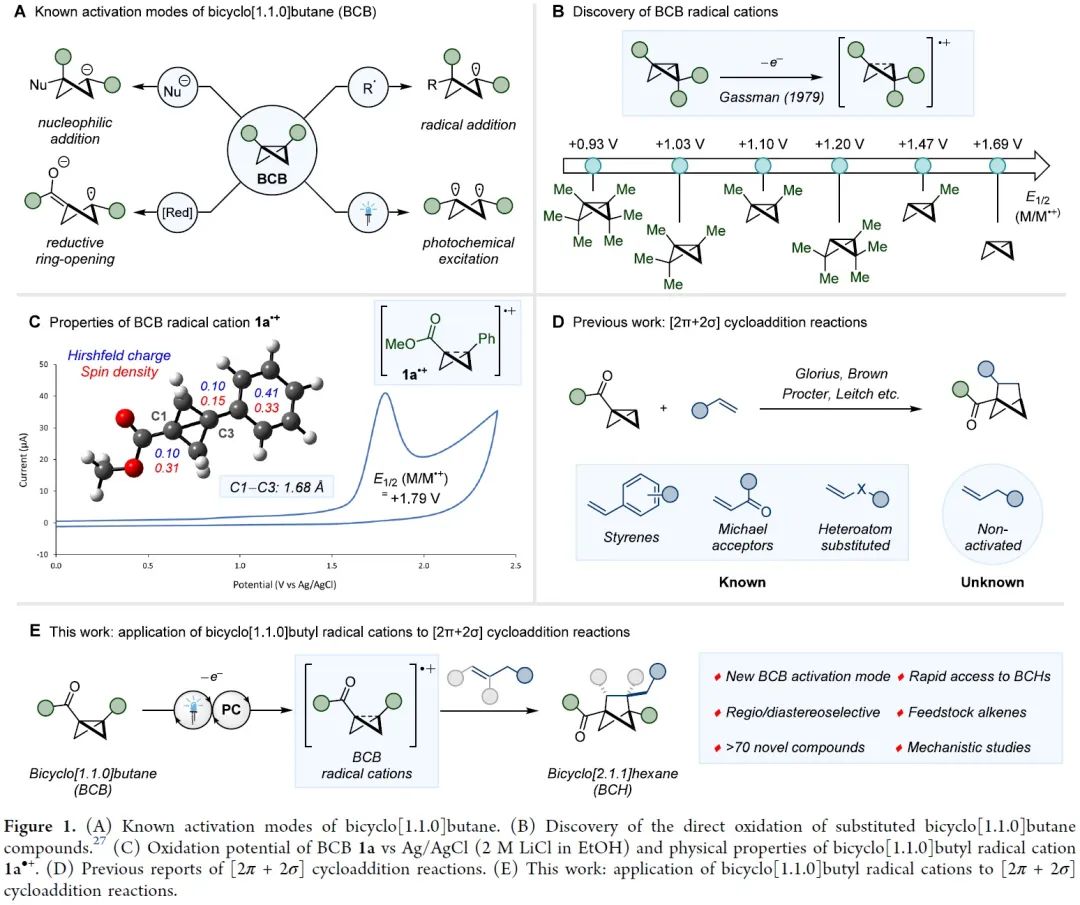
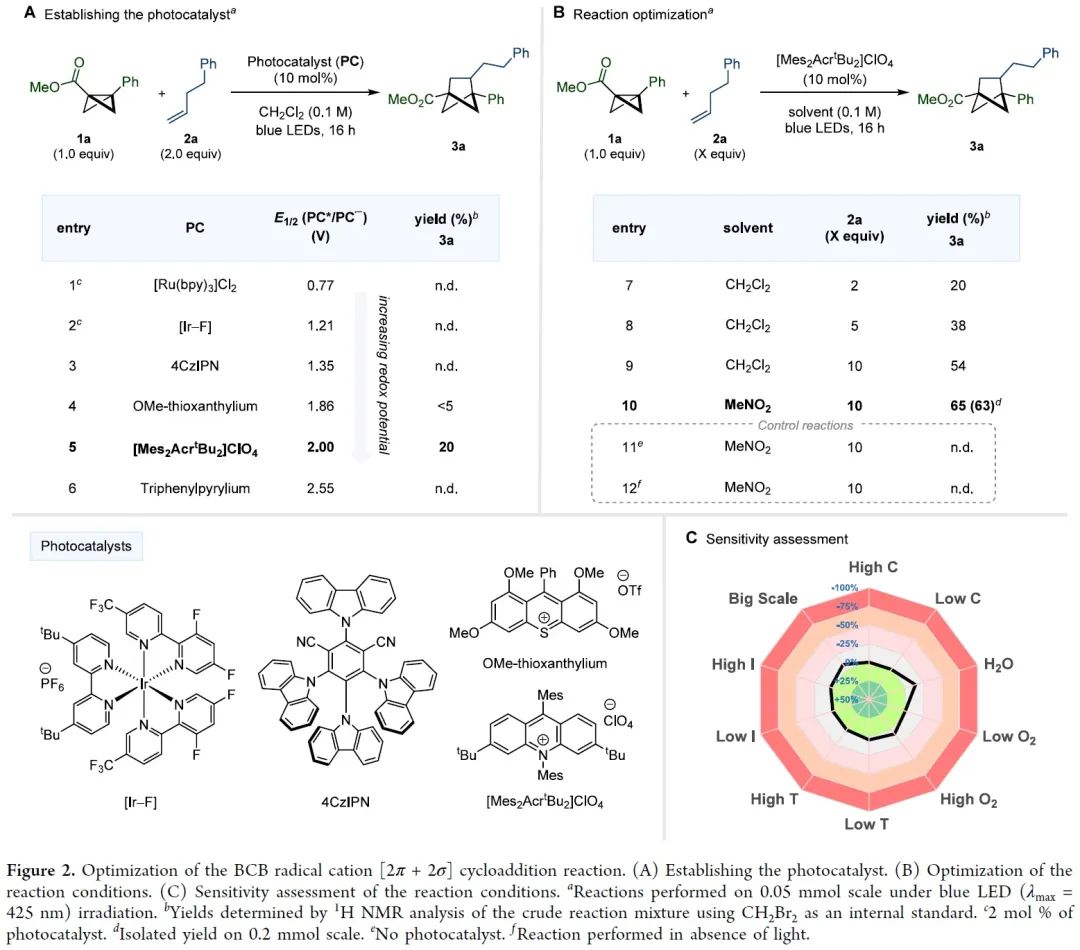
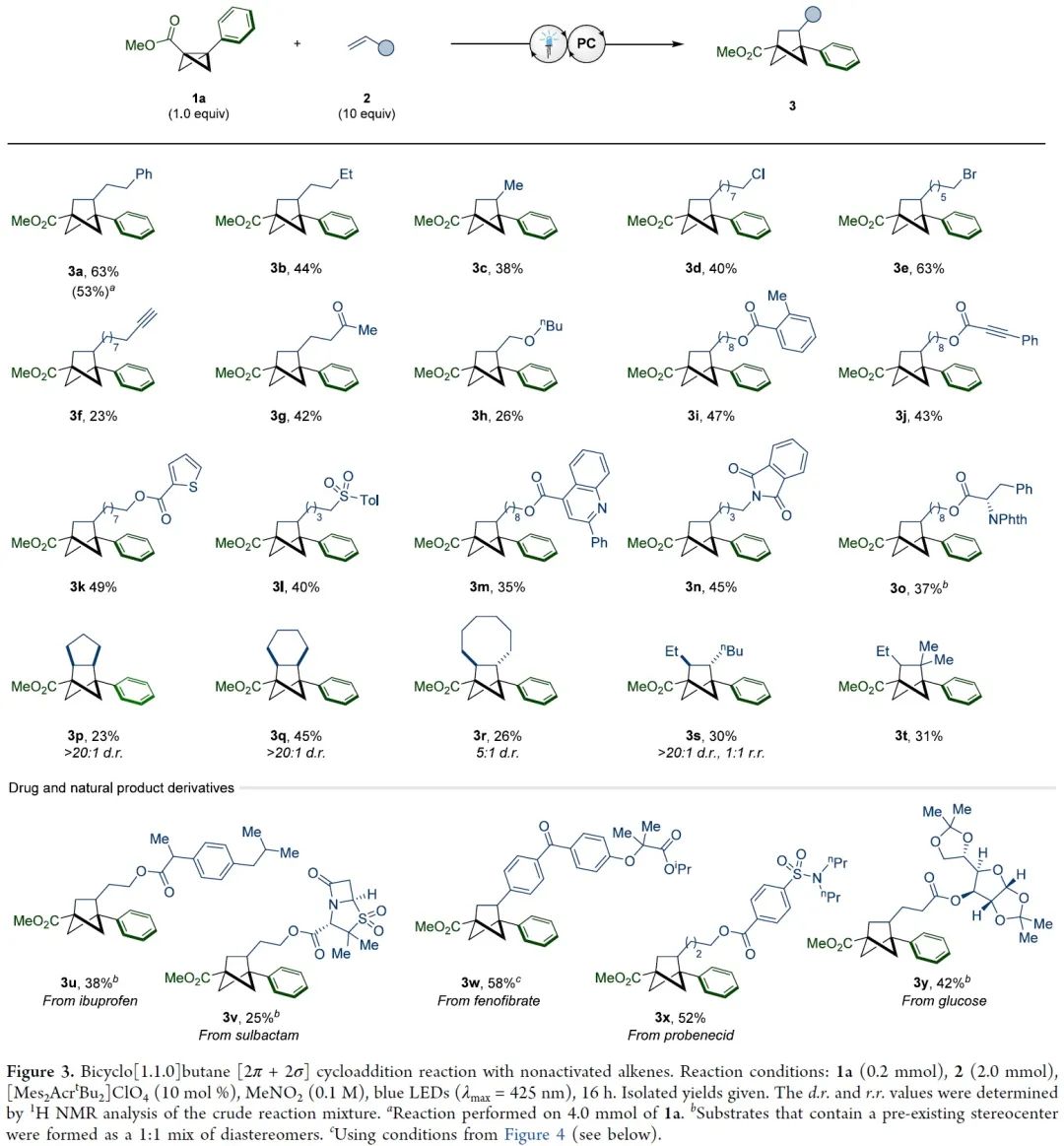
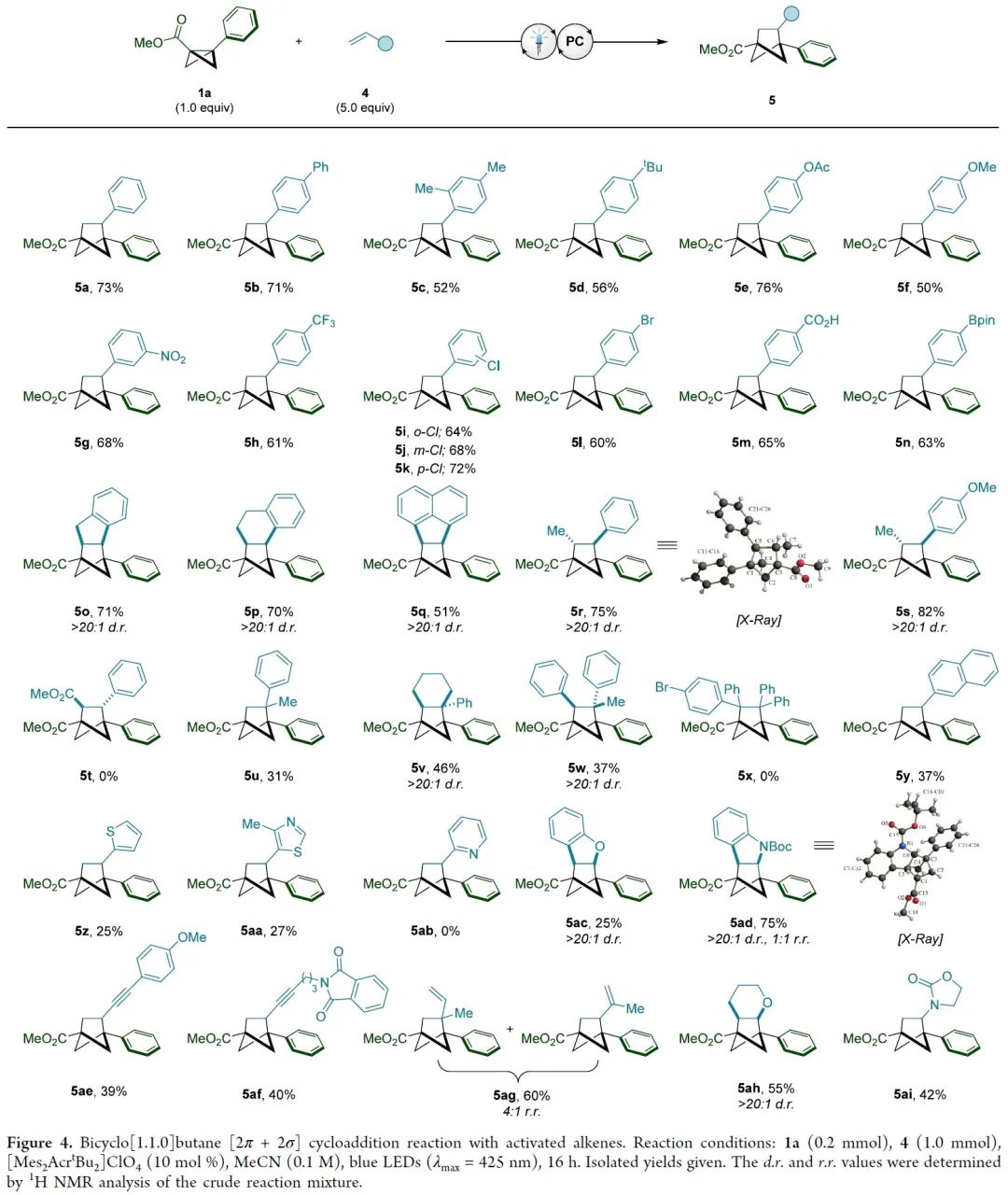
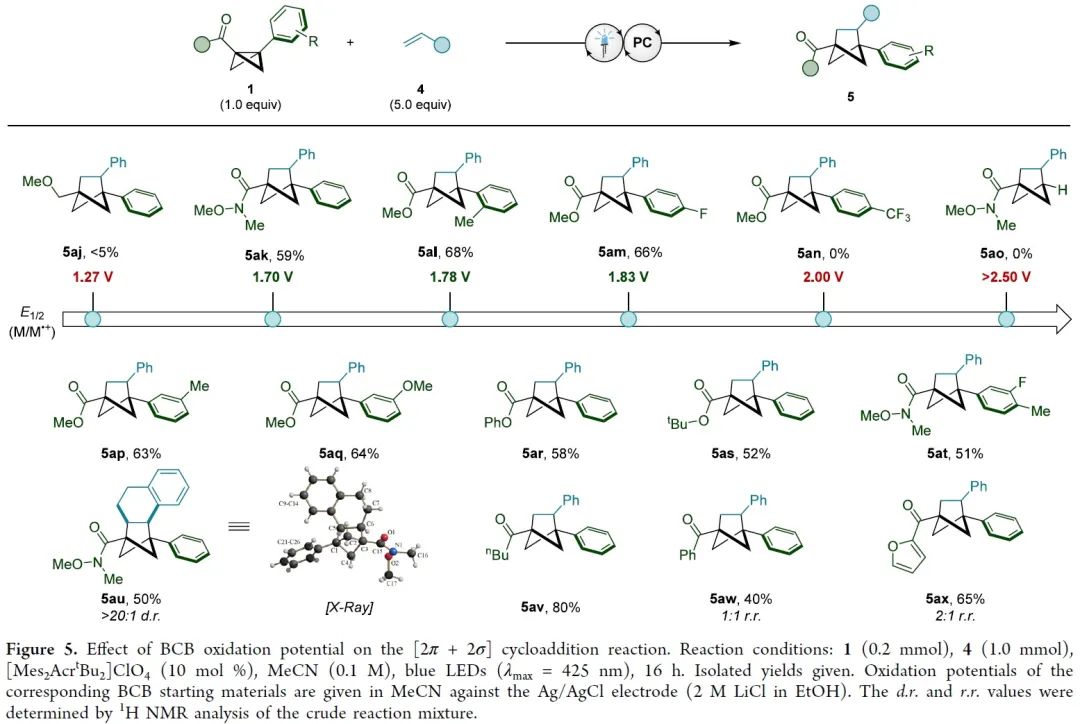
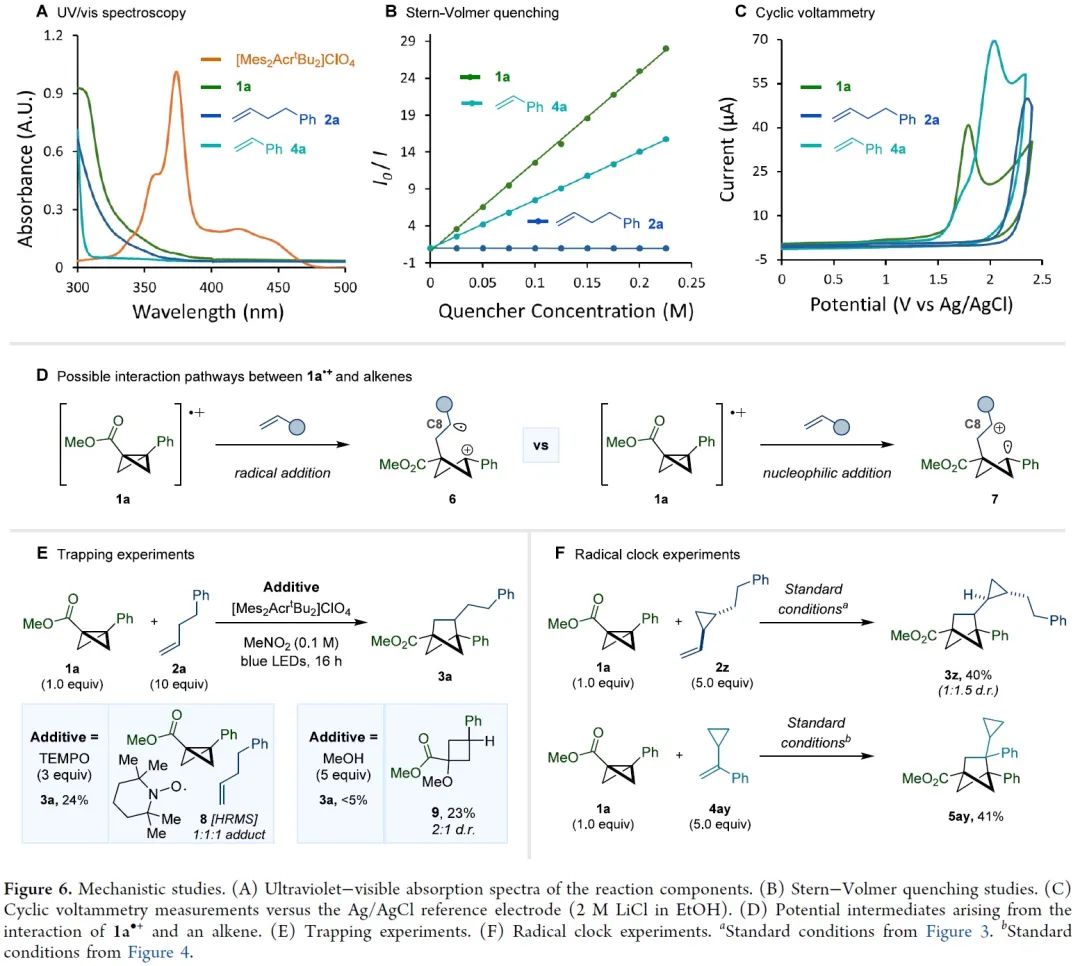
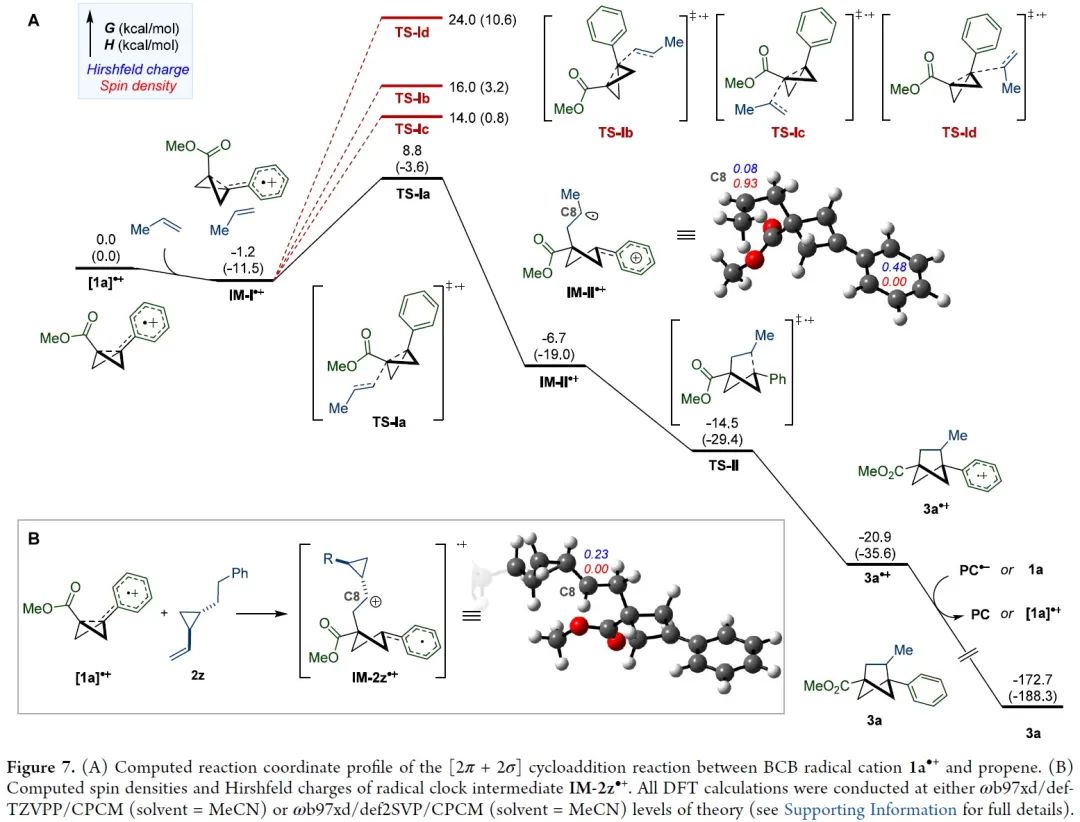
双环[1.1.0]丁烷(BCB)类化合物通过断开桥接的C1-C3键释放张力,具有高度多样化的反应活性,是生成富含sp3碳环和杂环的重要构件模块。其中,较为经典的反应模式是将亲核试剂或自由基加到缺电子化合物BCB的桥头(Figure 1A)。双环的σ框架很容易发生单电子氧化转变成自由基阳离子(Figure 1B)。此外,双环[1.1.0]丁烷类似物的溴化过程可能存在经单电子氧化产生的自由基阳离子中间体。然而,非选择性的亲核加成作为中间体的唯一转化方式,导致双环[1.1.0]丁基自由基阳离子的合成性研究严重不足。为了避免低分子量应变烃的相关问题,缺电子BCB 1a被选为研究对象。1a的半波电位+1.79 V(vs. Ag/AgCl),能被氧化(Figure 1C)。密度泛函理论(DFT)表明1a整体的电荷和自旋基本上是分布在BCB的桥联键和芳香环上。其中,C1和C3对整体自旋的贡献更大,而正电荷则更多地集中在芳环上。BCB的[2π+2σ]环加成反应中的烯烃双键上都需要一个自由基稳定基团、吸电子基团或杂原子(Figure 1D)。另外,苯乙烯自由基阳离子中间体与1a•+的电荷和自旋离域极其相似,有望发生[2π+2π]环加成反应。在此,美国加州大学洛杉矶分校K. N. Houk教授课题组联合德国明斯特大学Frank Glorius课题组成功将双环[1.1.0]丁基自由基阳离子应用于[2π+2σ]环加成反应中,成功得到双环[1.1.0]正己烷(BCH)(Figure 1E)。这种策略最显著的特点是BCB的单电子氧化活化模式可以实现优异的区域和非对映选择性。因烯烃2a在已知报道的环加成条件下不反应,所以被作者选为模型偶联底物。优化后的反应条件为:以[Mes2AcrtBu2]ClO4(E1/2(PC*/PC•–)=+2.00 vs SCE)为催化剂,MeNO2 (0.1 M)为溶剂,2a (2.0 mmol)与1a (0.2 mmol)在蓝色LED(λmax=425 nm)的照射下反应16 h,可以成功得到[2π+2σ]环加成产物(Figure 2A, entry 5)。反应条件的敏感性评估表明该反应对温度、浓度、氧气和光照强度的扰动表现出优秀的耐受性(Figure 2C)。接下来,在优化的反应条件下,作者系统性地研究了烯烃底物范围来评估反应策略的通用性及反应性的极限(Figure 3)。除了简单的碳氢化合物1-己烯(3b)外,丙烯(3c)气体也能成功转化为相应产物。伯卤代物(3d-e)、端炔烃(3f)、酮(3g)、醚(3h)、酯(3i)、内炔烃(3j)、噻吩(3k)、砜(3l)、喹啉(3m)、邻苯二甲酰亚胺(3n)和氨基酸衍生物(3o)等官能团均可与该反应相容,并获得所需产物的单一区域异构体。随后作者还发现一些天然产物和药物衍生烯烃在新开发的[2π+2σ]环加成反应中的耐受性(3u-y)。作者还成功将容易被光催化剂氧化的苯乙烯底物成功在该反应条件下以不错的产率转化为BCH产物(Figure 4)。另外,作者在探究BCB片段的电子效应时,发现环化能力与化合物氧化电位之间存在一定的关系(Figure 5)。没有吸电子基团的BCB底物,氧化电位比较低,只能生成微量产物(5aj)。而带有酯和酰胺的BCB底物,氧化电位不受影响,可以有效地生成所需的BCH产物(5ak-am)。5an产率比较低是因为底物带有强吸电子基团三氟甲基,氧化电位太高,达到了反应上限。因此可以根据循环伏安法的数据,确定反应性的氧化还原窗口,从而可以使用这种技术对BCB化合物进行分析判断是否反应。随后,作者设计了一些实验来证实BCB自由基阳离子1•+的反应活性,同时确定[2π+2σ]环加成反应的机理。紫外/可见光谱(Figure 6A)中[Mes2AcrtBu2]ClO4是425 nm处唯一的光吸收物种。Figure 6B表明,BCB 1a可以有效猝灭光催化剂激发态。苯乙烯4a的猝灭程度低于1a,这些结果与循环伏安完全吻合(Figure 6C)。此外,标准反应的量子产率为φ=3.7,说明这种环加成可以通过自由基链机制进行。总之,在未活化的烯烃中,BCB自由基阳离子1•+是[2π+2σ]环加成反应的关键中间体。鉴于氧化双环丁烷尚未得到充分探索,作者进一步做了机理实验(Figure 6D)。自由基捕获剂TEMPO加入并没有完全被抑制产物的形成,而加入MeOH后,反应主要生成9和微量目标产物(Figure 6E)。在TEMPO实验中,观察到1a、烯和TEMPO的1:1:1加合物8,表明反应中存在碳中心自由基。带有环丙烷的烯2z和4ay分别与1a反应均未检测到环丙烷开环(Figure 6F)。鉴于分子内环化的速度可能快于环丙烷开环的速度,这些结果并能完全确定BCB自由基阳离子与烯烃最初相互作用的性质。因此,作者通过计算来深入了解其作用机理。通过密度泛函理论(DFT)计算作者发现自由基阳离子1a•+与简单烯烃络合形成1M-I•+的过程中释放能量(Figure 7A)。烯烃片段插入BCB框架是一个动力学简单的过程(TS-Ia),与1M-I•+之间自由能垒为10.0 kcal/mol。后续形成中间体1M-II•+放热。经计算分析后作者得出结论:1a•+与烯烃发生初始相互作用后,中间体中的自旋和电荷密度分布在很大程度上取决于烯烃取代基的性质。分子内闭环步骤的速度要快于环丙烷开环。最后,热力学稳定的3a•+可以通过还原性的光催化剂或中性BCB分子发生还原,从而翻转自由基链并生成BCH产物3a。总之,作者报道了一种通过光氧化催化对双环[1.1.0]丁烷进行单电子氧化活化的新策略。其中,自由基阳离子能够以高度的区域选择性和非对映选择性方式进行 [2π+2σ]环加成反应,从而突显了合成用途。全面的实验和计算机理研究证实了BCB自由基阳离子的参与,并阐明了它们与烯烃相互作用的性质。 本文授权转载自微信公众号「CBG资讯」,未经许可谢绝二次转载,如需转载请联系C菌(微信号:chembeango101)